Le microalghe come bio-fabbriche per composti ad elevato valore aggiunto
di Giovanni Giuliano, Olivia Demurtas e Paola Ferrante - ENEA, Unità Tecnica Sviluppo Sostenibile ed Innovazione del Sistema Agro-Industriale
Le microalghe sono organismi fotosintetici unicellulari, che utilizzano la CO2 ambientale per produrre una vasta gamma di molecole interessanti, dai trigliceridi utilizzabili per la produzione di biodiesel, a molecole con azione nutraceutica, come i carotenoidi o gli acidi grassi omega-3 a catena lunga. Inoltre, esse possono essere ingegnerizzate per produrre farmaci. La loro elevata produttività, la crescita in terreni di coltura sterili, i costi decrescenti di produzione, la domanda crescente per alcune di queste molecole, rendono le microalghe molto interessanti per applicazioni nel campo della chimica fine, della nutraceutica, della produzione di farmaci
Le microalghe sono uno dei gruppi più antichi di esseri viventi. La loro fotosintesi è simile a quella delle piante superiori, ma esse sono generalmente più efficienti delle piante nel convertire l’energia solare. Crescendo in mezzi acquosi, esse utilizzano in maniera efficiente l’acqua, la CO2 ed i nutrienti. Le microalghe possono essere fotoautotrofe, eterotrofe, o mixotrofe. Le microalghe autotrofe utilizzano la radiazione solare per convertire l’H2O e la CO2 in O2 e zuccheri. Esse sono in grado di fissare efficientemente la CO2 da diverse fonti, tra cui l'atmosfera, i carbonati solubili e i gas di scarico industriali. Circa 1,8 kg di CO2 vengono fissati per ogni Kg (peso secco) di biomassa microalgale prodotta.
Le microalghe sono state proposte come “feedstock” per biocarburanti di terza generazione (Brennan e Owende, 2010; Mata et al, 2010). Esse presentano infatti una serie di vantaggi rispetto alle piante terrestri: 1) crescono velocemente e, potenzialmente, tutto l’anno; 2) possono essere coltivate su terreni marginali o desertici; 3) hanno bisogno di molta meno acqua per kg di biomassa prodotta rispetto alle colture terrestri; 4) molti ceppi possono essere coltivati in acque saline o salmastre; 5) sono in grado di sequestrare la CO2 dai gas di combustione di impianti industriali; 6) alcuni ceppi accumulano grandi quantità (30-40% sul peso secco) di trigliceridi, adatti per la produzione di biodiesel, mentre altri accumulano amido, adatto per la produzione di bioetanolo; 7) non richiedono l'applicazione di erbicidi o pesticidi; 8) alcuni ceppi possono essere utilizzati per scopi di biorisanamento.
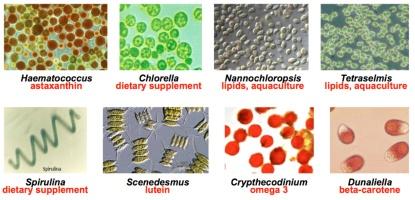
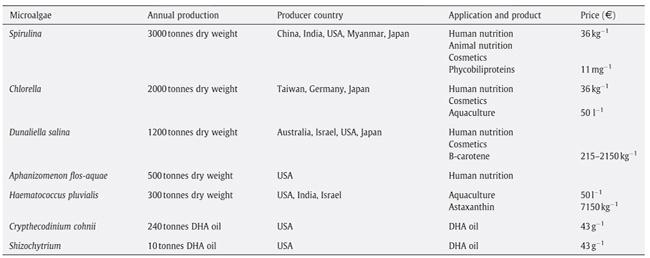
Nonostante questi vantaggi e le molte aziende start-up sorte nel settore dei biocarburanti da alghe, una filiera commerciale per tale produzione non ha ancora visto la luce. Il principale motivo è il costo, ancora troppo elevato, per la produzione di biomassa algale. Le applicazioni commerciali attuali delle microalghe sono principalmente nei settori degli integratori alimentari, della mangimistica, della cosmetica (figura 1, tabella 1).
Nonostante l’ampio utilizzo delle microalghe come “health food”, i “claims” sui loro effetti salutistici hanno talvolta una base poco scientifica: ad esempio, l'uso alimentare di Aphanizomenon può comportare rischi per la salute, a causa delle tossine presenti in alcune preparazioni (Dittmann e Wiegand, 2006). Per contro, altre specie di microalghe non presentano rischi e sono estremamente promettenti per potenziali applicazioni nei campi della nutrizione umana ed animale e nella produzione di molecole di interesse farmaceutico. Discutiamo qui sotto alcuni potenziali prodotti delle biotecnologie microalgali.
Tabella 1 - Produzione commerciale di microalghe
Fonte: Brennan e Owende, 2010 [1]
Omega-3
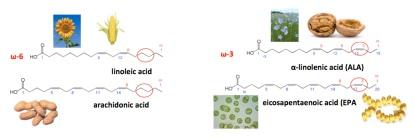
Molte microalghe accumulano elevati livelli di acidi grassi polinsaturi (PUFA) ω-3, come l’acido eicosapentaenoico (EPA) e l’acido docosaesaenoico (DHA). I PUFA ω-3 ed ω-6 sono acidi grassi essenziali nella dieta di molti animali, compresi gli esseri umani, i quali non sono in grado di sintetizzarli. Nella figura 2 sono rappresentati alcuni PUFA ω-3 ed ω-6 presenti nella nostra dieta e le loro fonti alimentari.
Diverse linee di evidenza suggeriscono che gli esseri umani si sono evoluti basandosi su una dieta che aveva un rapporto fra PUFA ω-6 ed ω-3 di 1:1, mentre nella dieta occidentale questo rapporto è aumentato a 15:1 (Simopoulos, 2008). Ciò si traduce in una maggiore attività delle risposte pro-infiammatorie mediate dall’acido arachidonico (un ω-6 a catena lunga), che a loro volta provocherebbero l’aumento dell'incidenza di malattie cardiovascolari e certi tipi di cancro. Un rapporto fra PUFA ω-6 ed ω-3 di 4:1 nella dieta riduce del 70% la mortalità nella prevenzione secondaria delle malattie cardiovascolari, mentre un rapporto di 2,5:1 riduce la proliferazione cellulare rettale in pazienti con cancro colorettale o sopprime l’infiammazione in pazienti con artrite reumatoide (Simopoulos, 2008). Inoltre, gli ω-3 hanno un ruolo importante nella funzione cerebrale: il DHA rappresenta il 40% dei fosfolipidi di membrana nel cervello e studi con primati non umani e neonati umani indicano che il DHA è essenziale per lo sviluppo funzionale del cervello, in particolare nei neonati prematuri (Simopoulos, 2011).
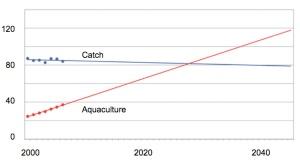
La maggior parte degli ω-3 nella nostra dieta è presente sotto forma di acido α-linolenico (ALA), un PUFA comune nelle noci e nell’olio di lino (figura 2). Nel nostro corpo, l’ALA viene convertito in DHA ed EPA in maniera inefficiente (<10%). Le principali fonti alimentari di DHA e EPA sono il pesce (tonno, salmone, sardine, aringhe) e l’olio di pesce. Le proiezioni mostrano una stabilizzazione della produzione ittica mondiale, con la cattura progressivamente sostituita dall’acquacoltura (figura 3), mentre la produzione mondiale di olio di pesce è attualmente di circa 1 Mtonnellate/anno e presenta un trend leggermente decrescente.
L’aumento del pesce prodotto tramite acquacoltura presenta un problema di sostenibilità: il mangime dei pesci più pregiati, come orate, branzini e salmoni, contiene proteine e olio derivati dal pesce catturato. Nel settore generale dell’acquacoltura il rapporto fra pesce catturato utilizzato per i mangimi e pesce prodotto è di 0,63, ma esso sale fino a 5,0 per il salmone (Naylor et al, 2009). La domanda crescente per le proteine e l’olio di pesce per acquacoltura ha portato ad un aumento del 30-40% del loro prezzo nel 2012.
Ma la domanda più forte di ω-3 a catena lunga proviene dal settore della nutrizione umana. Assumendo una dose giornaliera raccomandata di 2 grammi/giorno di olio ricco in ω-3 e una popolazione mondiale di 9 Mld nel 2050, la domanda potenziale per l’alimentazione umana è di 6,5 Mln di tonnellate, o 260 Mld di € al costo attuale di 40 €/Kg. Di questo, solo 1 Mln di tonnellate sarà verosimilmente coperto dall’olio di pesce. Appare evidente come fonti alternative a basso costo vadano reperite rapidamente.
Carotenoidi
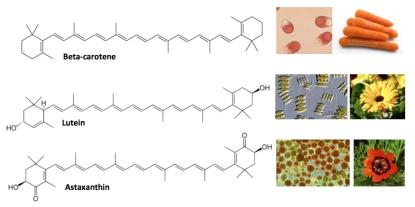
Il mercato dei carotenoidi è stimato in circa € 1,2 miliardi nel 2010, con la possibilità di crescere a € 1,4 miliardi nel 2018. Fra i composti più venduti sono il beta-carotene e la luteina (usati rispettivamente come supplementi alimentari per la prevenzione dell’avitaminosi A e della degenerazione maculare legata all'età, una malattia degenerativa della retina) e l’astaxantina, usata come additivo alimentare nell’industria ittica, ma con potenziali applicazioni anche come antiossidante nell’alimentazione umana (Greaves et al, 2012) (figura 4). I prezzi variano notevolmente, da 20 €/kg per il beta-carotene, a 4.000 €/kg per l’astaxantina. Il mercato attuale è dominato dai composti di sintesi chimica, con l'eccezione della luteina, che viene estratta dai petali della calendula e l’annatto, che viene estratto dai semi di Bixa orellana. Le microalghe sono in grado di sintetizzare la maggior parte di questi composti, spesso in una forma altamente pura, come il beta-carotene prodotto da Dunaliella salina e l’astaxantina prodotta da Haematococcus pluvialis. L’obiettivo della ricerca biotecnologica è ridurre i costi di produzione da microalghe fino a livelli competitivi con quelli dei composti di sintesi. Dato che tali costi sono da 20 a 4.000 volte più alti di quelli dei carburanti fossili, è evidente che questo è un obiettivo molto più facilmente raggiungibile, nel breve periodo, di quello della produzione di biocarburanti.
Proteine per uso alimentare
La Spirulina (ora Arthrospira) è un cianobatterio molto ricco in proteine, cosmopolita e capace di crescere in acque alcaline, ad un pH di 8-11 e temperature di 32-45 °C, con produzioni potenziali di 30 T proteina/ha/anno. La Spirulina veniva utilizzata come cibo dagli Aztechi e, a tutt’oggi, da varie popolazioni africane. Il suo utilizzo per complementare la parte proteica della dieta è stato proposto da numerosi gruppi (Khan et al, 2005).
Una potenziale applicazione della Spirulina, e delle microalghe più in generale, è la sostituzione delle proteine di origine animale nei mangimi, in particolare quelli usati in acquacoltura. Le proteine di origine microalgale si sono rivelate dei buoni sostituti per quelle di origine animale nella dieta dei pesci di allevamento (Olvera-Novoa et al, 2008).
Proteine per uso farmaceutico
Infine, le microalghe stanno emergendo come un sistema alternativo per la produzione di farmaci. Questa piattaforma relativamente nuova offre diversi vantaggi, tra cui: 1) un tempo breve dalla generazione della microalga transgenica allo “scaling up” 2) crescita rapida (tempo di duplicazione di poche ore) e facilità di coltivazione, 3) sicurezza, in quanto le microalghe non sono veicolo di agenti patogeni umani o animali e sono generalmente considerate sicure (Generally Accepted As Safe - GRAS), 4) crescita in condizioni sterili, il che agevola la produzione di proteine per uso umano. Il sistema modello Chlamydomonas reinhardtii, i cui genomi nucleare e plastidiale sono completamente sequenziati e facilmente trasformabili, è stato finora ampiamente usato per la produzione di proteine di interesse farmaceutico (Specht et al, 2010; tabella 2). Altre microalghe, con un potenziale utilizzo nella mangimistica, stanno ricevendo attenzione come veicoli per la produzione di vaccini orali contro le malattie animali più comuni.
Tabella 2 - Proteine di uso farmaceutico prodotte in Chlamydomonas

Fonte: Specht et al, 2010 [10]
Conclusioni
L’interesse per l’uso delle microalghe per la produzione di biocarburanti ha dato l’avvio ad una ricerca intensa sulla loro biologia. La genomica e la biotecnologia delle microalghe, fino a pochi anni fa oggetto di studio da parte di pochi aficionados, ricevono un interesse sempre maggiore da parte della comunità scientifica e dell’industria biotecnologica. L’ostacolo maggiore al loro utilizzo è l’attuale costo di produzione, calcolato in circa 5 €/kg di biomassa secca (Norsker et al, 2010). Tale costo va ridotto di almeno 10 volte per un utilizzo nel settore dei biocarburanti, mentre è già ora compatibile con la produzione di altri prodotti, come additivi alimentari, molecole per la chimica fine, proteine di interesse farmaceutico, vaccini animali a basso costo. La ricerca in questi settori è foriera di risultati interessanti nel breve-medio periodo.
Bibliografia
- Brennan L, Owende P (2010) Biofuels from microalgae-a review of technologies for production, processing, and extractions of biofuels and co-products. Renewable and Sustainable Energy Reviews 14: 557-577.
- Dittmann E, Wiegand C (2006) Cyanobacterial toxins-occurrence, biosynthesis and impact on human affairs. Mol Nutr Food Res 50: 7-17.
- Greaves R, Petkovich MCON, Miyazawa TCON, Albertini B (2012) Vitamin A and Carotenoids: Chemistry, Analysis, Function and Effects. Royal Society of Chemistry.
- Khan Z, Bhadouria P, Bisen PS (2005) Nutritional and therapeutic potential of Spirulina. Current pharmaceutical biotechnology 6: 373-379.
- Mata TM, Martins AA, Caetano NS (2010) Microalgae for biodiesel production and other applications: A review. Renewable and Sustainable Energy Reviews 14: 217-232.
- Naylor RL, Hardy RW, Bureau DP, Chiu A, Elliott M, Farrell AP, Forster I, Gatlin DM, Goldburg RJ, Hua K, Nichols PD (2009) Feeding aquaculture in an era of finite resources. Proc Natl Acad Sci U S A 106: 15103-15110
- Norsker NH, Barbosa MJ, Vermue MH, Wijffels RH (2011) Microalgal production-a close look at the economics. Biotechnol Adv 29: 24-27.
- Olvera-Novoa MA, Dominguez-Cen LJ, Olivera-Castillo L, Martinez-Palacios CA (2008) Effect of the use of the microalga Spirulina maxima as fish meal replacement in diets for tilapia, Oreochromis mossambicus (Peters), fry. Aquaculture Research 29: 709-715.
- Simopoulos AP (2008) The omega-6/omega-3 fatty acid ratio, genetic variation, and cardiovascular disease. Asia Pac J Clin Nutr 17 Suppl 1: 131-134.
- Simopoulos AP (2011) Evolutionary aspects of diet: the omega-6/omega-3 ratio and the brain. Mol Neurobiol 44: 203-215.
- Specht E, Miyake-Stoner S, Mayfield S (2010) Micro-algae come of age as a platform for recombinant protein production. Biotechnol Lett. 32(10):1373-83.